
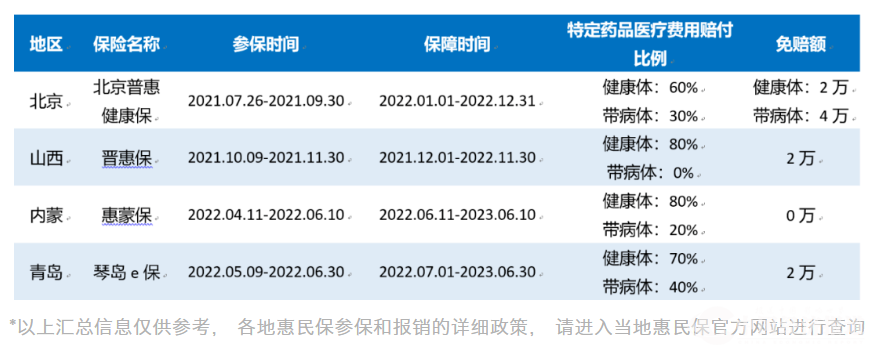
信达生物达伯坦®(佩米替尼)被纳入北京、山西、内蒙、青岛多地惠民保
信达生物的达伯坦®(化学名:佩米替尼,Pemigatinib;英文商标:Pemazyre®)被纳入北京、山西、内蒙、青岛多地惠民保的特定药品报销目录,适应症是复发的FGFR2基因融合/重排的局部晚期或转移性胆管癌。
达伯坦®(佩米替尼)是一种FGFR1/2/3强效选择性的小分子口服抑制剂。全球注册临床研究提示,对于FGFR2融合/重排的经治胆管癌患者客观缓解率(ORR)为37.0%,中位无进展生存期(mPFS)为7.0个月,中位总生存期(mOS)为17.5个月,对有应答的人群,中位生存甚至达到了30.1个月(数据截止日期:2020年4月7日)。中国桥接试验中FGFR2融合/重排经治胆管癌患者接受佩米替尼治疗ORR达到50%,中位无进展生存期达到6.3个月(数据截止日期:2021年1月29日)。对于晚期胆管癌患者来说,这是一个重大的生存突破。
上海复旦大学附属中山医院周俭教授表示:“胆管癌是第二常见的原发于肝脏的恶性肿瘤,亚洲地区发病率较高,大部分胆管癌患者首次诊断时肿瘤即处于无法切除或者转移的状态,现有治疗疗效有限,亟待可以提高疾病控制、改善患者生存治疗的药物。佩米替尼在国内和国外的临床研究结果均表明其在(肝内)胆管癌患者身上有令人满意的抑制肿瘤效果,同时具有良好的安全性。佩米替尼作为首个在国内胆管癌受试者获批的选择性FGFR1/2/3的选择性酪氨酸激酶抑制剂,相信佩米替尼未来会为部分的胆管癌患者提供生存获益。”
“我们很高兴看到达伯坦®(佩米替尼)通过了国家药品监督管理局的批准用于胆管癌的二线治疗,这是本产品开发的又一重要里程碑,同时也为中国胆管癌患者提供了新的治疗选择”,信达生物制药集团总裁刘勇军博士强调说,“达伯坦®在既往经过至少一线标准治疗失败的存在FGFR2融合的晚期胆管癌患者的临床试验数据展示出了令人满意的安全性及疗效,进一步增强了我们深入探索和拓宽产品链的信心。目前达伯坦®用于晚期一线胆管癌治疗的临床试验正在包括中国在内的全球范围开展,未来我们还将围绕达伯坦®进行深度的临床开发,积极探索其他适应症,我们相信将为更多的癌症患者将带来临床获益。”
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的理想和目标。
来源:信达生物、美通社























